- コンサルテーション室
- 中央管理ユニット
- サイト管理ユニット
- ネットワーク事務局
- 事務局部門
特定臨床研究を計画している申請者は、下記書類を用意した上で、委員会事務局までメールにて申請ください。
尚、計画書等作成に際し、質の高い臨床研究を実施していただく支援として、コンサルテーション室にて相談を承ります。事務局へご連絡ください。
申請に際し、所定の審査料を研究代表医師へ請求させていただきます。支払い方法については、原則として一括払いとなります。
| 区分 | 金額(税別) |
|---|---|
| 新規申請 | 400,000円 |
| 定期報告(年1回) | 200,000円 |
 クリックしてPDFを表示
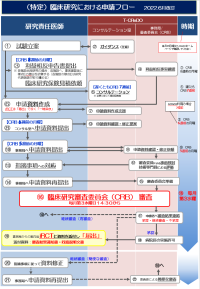
新規申請の流れ(参考例)は、臨床研究における申請フローイメージを参照下さい。
クリックしてPDFを表示
新規申請の流れ(参考例)は、臨床研究における申請フローイメージを参照下さい。
(2023年3月改定)
臨床研究申請システム
(臨床研究法)
資料名 |
|---|
| 経過措置における提出書類一覧 |
| 臨床研究法(平成29年法律第16号) |
| 臨床研究法施行規則(平成30年厚生労働省令第17号) |
| 臨床研究法の施行に伴う政省令の制定について(局長通知) |
| 臨床研究法施行規則の施行等について(課長通知) |
| 臨床研究法における臨床研究の利益相反管理について(課長通知) |
|
※Q&Aなどの最新情報につきましては、厚生労働省のホームページをご確認ください。 臨床研究法について(厚生労働省) |
特定臨床研究につきましては、委員会本申請に先立ち利益相反委員会に諮る必要がございます。下記書類一式を用意の上、事務局へ提出ください。
【提出目安:委員会審査前々月末まで】
書式番号/形式 |
書式名 |
|---|---|
定型書式 |
利益相反管理基準(様式A)及び利益相反管理計画(様式B)、利益相反自己申告書(様式C) ※各個人ごとにファイルを作成ください |
利益相反委員会の意見書がお手元に届きましたら、下記書類一式を用意の上、事務局へ提出ください。
【提出目安:委員会審査4週間前の月曜日まで】
書式番号/形式 |
書式名 |
|---|---|
統一書式 02 |
新規審査依頼書 (2019.4.1) |
定型書式 |
jRCT登録システム へログインし、実施計画を作成ください 省令様式1 実施計画 (記入例付) jRCT操作マニュアル ※作成に際し、操作マニュアルおよび実施計画(記入例付)を参照ください |
統一書式 01 |
研究分担医師リスト |
定型書式 |
利益相反管理基準(様式A)及び利益相反管理計画(様式E)v3.1 ※各個人ごとにファイルを作成ください |
任意形式 |
研究計画書手引き(臨床研究法対応版)v4.0 (2023.10.1) |
任意形式 |
説明文書・同意書作成の手引き(臨床研究法対応版)v4.0 (2023.10.10) |
任意形式 |
疾病等が発生した場合の対応に関する手順書 v2.1 (2020.2.6) |
任意形式 |
モニタリングに関する手順書(雛形) (2022.10.11) |
任意形式 |
監査に関する手順書(ある場合) |
任意形式 |
統計解析計画書(ある場合) |
任意形式 |
医薬品等の概要を記載した書類(ある場合) |
その他 |
※必要に応じて追加書類の提出を依頼する場合がございます |
筑波大学附属病院 つくば臨床医学研究開発機構
臨床研究推進センター
内線:7562 E-mail:rinshokenkyu[@]un.tsukuba.ac.jp
([@]を@に置き換えてください。)