臨床研究法に基づき策定された実施計画および研究計画書を遵守して臨床研究を実施ください。実施中は、変更申請および疾病等発生時の報告、年1回の定期報告等の各種手続きが必要です。
下記を参照の上、各種手続きについて滞りなくご対応をお願いいたします。
特定臨床研究の実施にあたり、特に注意すべき点をまとめました。当院で発生した重大な不適合事例を踏まえ、作成した重要ポイントとなりますので、実施前に必ず確認ください。
特定臨床研究を成功させるための重要なポイント(研究責任(代表)医師・分担医師用)v3.0
実施中の臨床研究において、変更がある場合は下記書類一式をご用意の上、速やかに変更申請を事務局へご提出ください。
書式番号/形式 |
書式名 |
|---|---|
統一書式 03 |
変更審査依頼書 |
定型書式 |
実施計画に変更がある場合は、jRCT登録システム へログインし、実施計画変更届出書・実施計画を作成ください。 省令様式2 実施計画事項変更届書 省令様式3 実施計画事項軽微変更届書 jRCT操作マニュアル 操作については「操作マニュアル」p35~を参照ください。 |
任意形式 |
変更一覧(新旧対応表) 変更がある文書 |
その他 |
※必要に応じて追加書類の提出を依頼する場合がございます |
 クリックしてPDFを表示
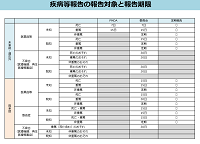
臨床研究法においては、臨床研究の実施によるものと疑われる疾病等の発生および、医療機器等の不具合に際し、報告日数が厳密に定められております。
報告対象については速やかに報告をお願いいたします。
クリックしてPDFを表示
臨床研究法においては、臨床研究の実施によるものと疑われる疾病等の発生および、医療機器等の不具合に際し、報告日数が厳密に定められております。
報告対象については速やかに報告をお願いいたします。
SAE報告期限は右図(PDF)を参照下さい。
書式番号/形式 |
書式名 |
|---|---|
統一書式 08 |
医薬品の疾病等報告書 (2019.12.27) |
統一書式 09 |
医療機器の疾病等又は不具合報告書 (2019.12.27) |
統一書式 10 |
再生医療等製品の疾病等又は不具合報告書 (2019.12.27) |
統一様式 |
書式8-10の詳細記載用書式 (2019.12.27) |
その他 |
※必要に応じて追加書類の提出を依頼する場合がございます |
厚生労働省に実施計画を提出した日から起算して1年ごと、当該期間満了後2ケ月以内に委員会へ定期報告を提出する必要があります。また、厚生労働大臣への定期報告は、 認定委員会が意見を述べた日から、1ケ月以内に提出することが定められています。
書式番号/形式 |
書式名 |
|---|---|
統一書式 05 |
定期報告書 (2019.4.1) |
定型書式 |
jRCT登録システム へログインし、定期報告書を作成ください。 通知様式3 定期報告書 |
定型書式 |
利益相反管理基準(様式A)及び利益相反管理計画(様式E)v3.1 ※定期報告前に利益相反委員会へ各個人の利益相反について申告し、申告内容を事実確認する必要がございます。 |
その他 |
※必要に応じて追加書類の提出を依頼する場合がございます |
各種規則、研究計画書、手順書等の不遵守および研究データの改ざんや捏造が発覚した場合は、速やかに報告ください。 場合によっては、対象者の人権や安全性、研究結果の信頼性に影響を及ぼす重大な不適合にあたる場合もありますので、研究責任医師のみならず研究分担医師からの直接報告も受け付けます。
書式番号/形式 |
書式名 |
|---|---|
統一書式 07 |
重大な不適合報告書 (2019.4.1) |
その他 |
※必要に応じて追加書類の提出を依頼する場合がございます |
筑波大学附属病院 つくば臨床医学研究開発機構
臨床研究推進センター
内線:7562 E-mail:rinshokenkyu[@]un.tsukuba.ac.jp
([@]を@に置き換えてください。)